
日新製薬では『品質第一』の経営理念のもと、GMP※を遵守し、信頼できる医薬品を供給するため以下の品質方針を掲げています。
※GMP(Good Manufacuring Practice)国が定める医薬品の製造管理および品質管理に関する基準
品質方針
日新製薬株式会社は医療への貢献を使命とし、患者様、医療関係者様を第一に信頼できる医薬品を供給するために、以下を宣言致します。
- 当社コンプライアンス・プログラムを組織内に周知し、法令遵守を徹底します。
- 技術・知識の習得や新技術への挑戦など、社員のスキルアップに取り組みます。また、そのために効果的な教育研修訓練を実施します。
- 製剤設計、品質管理、品質保証を包括的に真摯に取り組みます。
- 医薬品の根幹は品質であることを自覚し、高水準の品質を構築するために継続的な改善に取り組みます。
- 医療費負担増、少子高齢化、社会保障財政の逼迫・・・今必要とされているジェネリック医薬品や、製造を受託する医薬品を、信頼できる医薬品として供給することで医療に貢献します。
| 代表取締役社長(責任役員) | 川俣 知己 | |
| 総括製造販売責任者 信頼性保証本部長 |
(責任役員) | 近野 保 |
| 生産本部長(責任役員) | 大石 政道 | |
この経営者による宣言(品質方針)達成のために、日新製薬で行っている主な取り組みについてご紹介します。

原薬の選定並びに製造所管理
日新が製造販売する医薬品に使用する原薬、更には原薬製造所、製剤製造所あるいは供給業者を含めて評価、選定しています。更にそれらを開発部門、品質保証部門、調達部門が連携して継続的に管理することで、日新が製造販売する医薬品の品質の担保及び安定供給に努めています。
1.原薬の選定( 詳細はこちら )
求める原薬要件を明確化し、原薬の品質を含め以下の評価を行い、品質の高い、安定供給が可能な原薬を選定しています。
- 原薬の製造方法
特許に抵触していないか、類縁物質、残留溶媒及び元素不純物の管理は適切かなど、原薬の製造方法に係る品質の確認を行います。 - 品質評価
物性・結晶形・粒度・純度など原薬そのものの品質の確認を行います。 - 原薬供給業者(製造所、国内管理人)の評価
科学的な知識、日本の薬事制度の知識を適切に有し、コミュニケーションがスムーズに行えるか、企業体制に問題がないかなどの評価を行います。 - 製造所の実地確認
選抜した製造所について、日新製薬の担当者が実地確認にて評価を行います。
2.製造所の管理
日新は、製造販売業者として、品質の高い医薬品を安定的に提供できるよう、原薬製造所及び製剤製造所に対し、継続的な管理に努めています。
- 取決め書
原薬製造所や、製剤製造所との間では、同じ品質のものが安定的に納入されるよう、取決めを行います。異常が発生した場合の迅速な連絡体制、製造方法等を変更する場合の連絡体制等を取り決めることにより、タイムリーな情報共有を行っています。 - 製造所監査
原薬製造所、製剤製造所について、年間計画を立て、品質保証部門の担当者が、定期的に実地監査を行い、適宜課題点を指摘し、この課題点についてのフォローアップを行い、更なる品質の向上に努めています。また、監査結果については、経営層を含めた関係者に周知、共有化し、迅速な対応につなげています。 - 監査項目
製造所実地監査では、以下のような項目について確認しています。
システムに関する調査
- 品質システム
- 製造システム
- 試験室管理システム
- 構造設備システム
- 包装表示システム
- 製品原材料等保管システム

対象品目の調査
- 製造記録
- 試験記録
- バリデーション※結果
(※製造管理及び品質管理の方法が期待される結果をもたらすか検証すること)
医薬品の製造
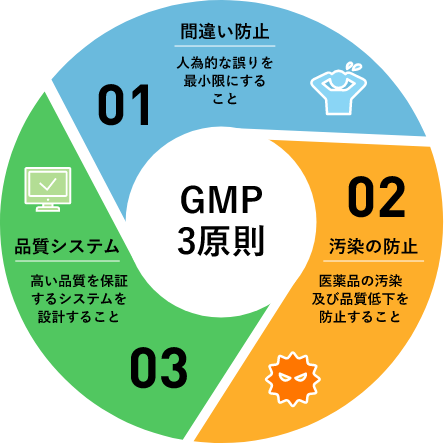
日新の製剤製造所では、GMPを遵守して製造管理及び品質管理を行っています。
このGMPには3つの原則があり、これら原則を遵守するために、「関係法規を含むGMP省令や衛生管理などの教育の徹底」、「コンピューターシステムの構築」、「強固なガバナンス体制の構築」を図っています。
日新の製剤製造所では自社医薬品だけでなく、70社を超える国内外の医薬品製造販売企業より製造を受託しています。
医薬品製造所として、委託者及び行政による製造所監査を毎月2~5回程度受けております。
監査を通し、様々な視点からの意見を頂きますので、GMP管理の徹底に役立てています。
- GMP教育
品質向上のために社員一人ひとりが高い意欲と知識を持ち、高品質の医薬品製造を行うため、医薬品の製造管理及び品質管理に携わる社員に対し、関係法令を含め、医薬品・医薬部外品GMP省令や衛生管理の目的、考え方等の概要について教育訓練を行っています。定期教育訓練
年間計画に基づき毎月実施しています。
随時教育訓練
各部門が「変更を実施する場合」、「異常・逸脱管理で措置を講じた場合」、「品質情報等に対して対策を講じた場合」等、必要に応じて実施しています。
手法等教育訓練
他部門から出た「異常・逸脱」等について情報を共有し、人為的ミスの解決策を図るため実施しています。
- コンピュータシステムの構築( 詳細はこちら )
日新では、製造管理システム(MES)、品質管理システム(LIMS)、製造実績データシステム(SCADA)、空調監視システムを連携させ、原料の入荷から製品の出荷まで、すべての製造工程及び試験工程をコンピュータシステムにて管理しています。

強固なガバナンス体制の構築
『品質第一』の経営理念の実現のため、全ての経営層が参加する品質会議を実施しています。
責任者朝礼
日々の製造状況の確認や製造時のトラブル、市場からの品質情報などの情報を共有するために、経営層を含む各製造所の製造部門及び品質部門の責任者が毎日集まり(オンライン接続を含む)、意識の共有を行っています。
製造会議
月1回、経営層を含む、製造部門及び品質部門の責任者が集まり、異常逸脱、変更管理、品質情報、教育訓練の実施状況などの確認及び情報共有を行っています。
三役連絡会
総括製造販売責任者、品質保証責任者、安全管理責任者及び経営層、安全管理部門、品質保証部門、薬事部門及び営業部門が参加し、異常逸脱、変更管理(薬事判断の適切性)、品質情報、安全管理情報、安定供給、製造所管理情報、関連通知等について確認及び情報共有を行っています。
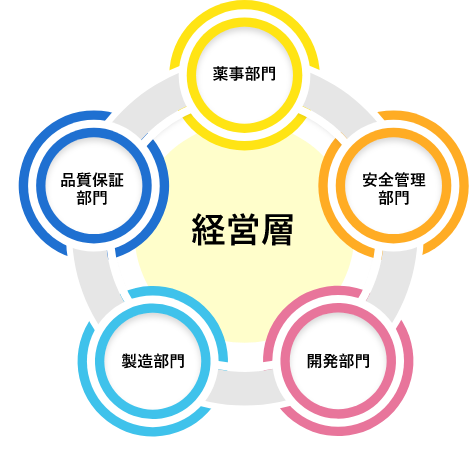
開発会議
経営層及び開発部門が参加し、製品の原薬選定を含めた開発状況などの情報共有並びに意思決定を行っています。
日新製薬では、これらすべての会議に経営層が参加することで、日々の製造状況、開発状況を経営陣がタイムリーに把握、指示を行うことで、経営層との意思の共有を図り、経営理念の実現に向けた活動を、経営層を含む社員が一丸となって取り組んでいます。



